

2021年10月6日,上海交通大学药学院邓刘福教授团队和山东省肿瘤医院于金明院士团队合作在国际著名综合性学术期刊 Science Advances上发表题为“ZBP1-MLKL Necroptotic Signaling Potentiates Radiation-induced Antitumor Immunity via intratumoral STING pathway activation”的研究论文。
根据免疫原性程度,细胞死亡方式分为非免疫原性死亡(如凋亡)和免疫原性死亡(如坏死性凋亡、铁死亡等)。关键科学问题是:坏死性凋亡在放疗后如何启动抗肿瘤免疫应答,死亡重编程是否可作为肿瘤治疗新思路?该研究发现:放疗可显著上调肿瘤细胞的ZBP1表达,进而ZBP1可激活MLKL介导的细胞坏死性凋亡通路。令人惊讶的是,ZBP1-MLKL通路可调节放疗后肿瘤细胞线粒体DNA(mtDNA)的释放,该过程被胞质内cGAS-STING通路密切监视,继而启动抗肿瘤天然免疫和适应性免疫应答。Caspase-8可作为死亡重编程的靶标增强肿瘤放疗效果。
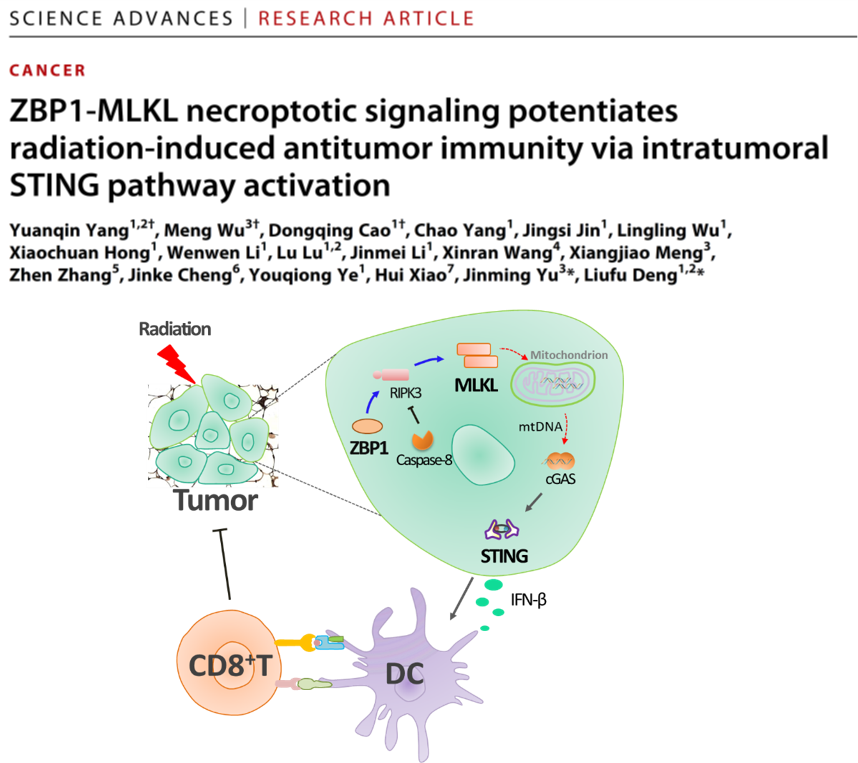
细胞坏死性凋亡是一种非常重要的免疫原性死亡形态,那么坏死性凋亡在放疗诱导的抗肿瘤免疫应答中究竟发挥怎样的作用?该研究首次报道了ZBP1具备促进抗肿瘤免疫应答的特性,具体机制为ZBP1作为感受器启动了MLKL通路,引起了放疗后肿瘤细胞的坏死性凋亡,该过程不仅增强了DC细胞的抗原交叉激活能力,还提高了CD8+ T细胞的浸润程度及抗原特异性CD8+ T细胞的功能。此外,研究者通过构建小鼠双侧皮下瘤模型发现,肿瘤细胞上的MLKL可促进放疗诱导的远端效应,进一步核实了免疫系统的参与。
放疗的抗肿瘤作用依赖于DNA感受通路cGAS-STING,但是cGAS又是如何被激活的?目前的主流观点认为放疗诱导微核的形成,微核膜的不完整性导致cGAS聚集并识别微核DNA,最后激活STING-type I IFN通路。该研究发现了一条平行于微核形成启动免疫识别的重要通路,即放疗激活cGAS-STING通路的根源在于mtDNA, ZBP1-RIPK3-MLKL通路活化是促使线粒体不稳定而释放mtDNA的主导因素。因此,该研究为理解肿瘤细胞损伤与天然免疫识别的关系提供了崭新观点。
放疗抵抗是临床亟待解决的难题,能否通过提高肿瘤细胞的坏死性凋亡来增强放疗效果?Caspase-8具有多重功能,一方面介导细胞凋亡,另一方面抑制细胞坏死性凋亡。那么,是否可通过抑制caspase-8活性来重编程放疗后的肿瘤细胞死亡?该研究发现,caspase-8缺失后能够显著增强放疗后肿瘤细胞内ZBP1-MLKL通路的活化,并且可显著提高放疗后的抗肿瘤免疫应答。这些证据提示caspase-8可作为肿瘤细胞死亡重编程的靶标。
综上,该研究揭示了放疗后受损的肿瘤细胞启动天然免疫识别的新机制,提出了死亡重编程可作为增强肿瘤放疗效果的新思路。该项研究为理解免疫原性死亡启动抗肿瘤免疫应答提供了新视角,为增强肿瘤治疗提供了新靶标。
该论文的通讯作者是上海交通大学药学院邓刘福教授和山东省肿瘤医院于金明院士,第一作者是上海交通大学医学院博士生杨远勤、山东省肿瘤医院助理研究员吴萌和上海交通大学医学院技术员曹冬青。该研究受到了国家自然科学基金、国家海外青年高层次人才计划、上海市科委“科技创新行动计划”、上海交通大学“医工交叉研究基金”等项目资助。
文章链接:https://www.science.org/doi/10.1126/sciadv.abf6290